may 16, 2023
Philips actualiza los resultados de las pruebas realizadas con los dispositivos de terapia del sueño CPAP/BiPAP
Ámsterdam, Países Bajos - Royal Philips (NYSE: PHG; AEX: PHIA) ofrece hoy información actualizada sobre el exhaustivo programa de pruebas e investigación de su filial Philips Respironics, tras las notificación en junio de 2021 de la Nota de Seguridad para abordar los posibles riesgos para la salud relacionados con la espuma de insonorización de poliuretano con base de poliéster (PE-PUR) en dispositivos de terapia del sueño y ventiladores.
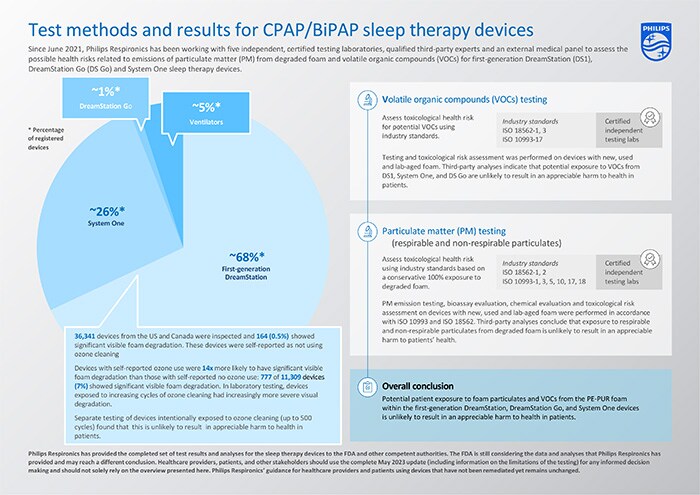
Ya se han completado las evaluaciones de riesgo para los dispositivos de terapia del sueño CPAP/BiPAP incluidos en la Nota de Seguridad, es decir, los dispositivos DreamStation, System One y DreamStation Go de primera generación, que representan aproximadamente el 95% de los dispositivos registrados en todo el mundo. Las evaluaciones se basan en las actualizaciones anteriores de diciembre 2021, junio 2022 y diciembre 2022. Además, se han completado las pruebas y los análisis de los dispositivos DreamStation de primera generación que han sido expuestos a la limpieza con ozono.
Métodos de ensayo
El programa de pruebas e investigación se ha llevado a cabo junto con cinco laboratorios de pruebas independientes y certificados, y los resultados han sido revisados y evaluados por expertos cualificados de terceros y Philips Respironics, así como por un grupo médico externo.
Los métodos de prueba aplicados -que comprenden la planificación de las pruebas, su ejecución y la interpretación de los resultados de las evaluaciones de riesgo completadas- se ajustan a las normas industriales ISO 18562 [1,2] e ISO 10993 [3] aplicables. El diseño de los métodos de ensayo aplicados se apoyó además científicamente en una minuciosa consideración y mitigación de las limitaciones inherentes a los ensayos. Por ejemplo, las pruebas se realizaron en múltiples dispositivos usados, con diferente cantidad de uso por parte del paciente y degradación visual de la espuma observada, y en espuma envejecida en laboratorio que se había degradado intencionadamente en diferentes grados. En las evaluaciones de riesgo se incluyeron supuestos muy conservadores. Al final de este comunicado de prensa figuran más ejemplos.
"Nuestra primera prioridad es la salud y el bienestar de los pacientes", declaró Roy Jakobs, director general de Royal Philips. "Por lo tanto, nos hemos centrado en el programa integral de pruebas e investigación para obtener más claridad sobre la seguridad de los dispositivos afectados, y en proporcionar dispositivos de sustitución a los pacientes". Las evaluaciones de riesgo por terceros para los dispositivos de terapia del sueño presentadas hoy son positivas y tranquilizadoras, y estamos avanzando a buen ritmo en la reparación de los dispositivos afectados. Las autoridades competentes de todo el mundo, incluida la FDA, siguen examinando los resultados de las pruebas y las evaluaciones. Compartimos el mismo objetivo de garantizar la seguridad de los pacientes y la calidad de la asistencia sanitaria, y seguimos comprometidos en colaborar estrechamente con estos organismos. La finalización de las pruebas y la reparación de los dispositivos afectados siguen siendo nuestras principales prioridades."
Resultados de las pruebas y análisis de los dispositivos de terapia del sueño no expuestos a la limpieza con ozono
El conjunto completo de resultados de ensayos y análisis para la primera generación de dispositivos de terapia del sueño DreamStation, System One y DreamStation Go indica que es improbable que la exposición potencial de los pacientes a las partículas de espuma (PM) y a los compuestos orgánicos volátiles (COV) procedentes de la espuma PE-PUR de estos dispositivos provoque un daño apreciable para la salud de los pacientes. Las pruebas realizadas y las conclusiones se resumen en la tabla siguiente.
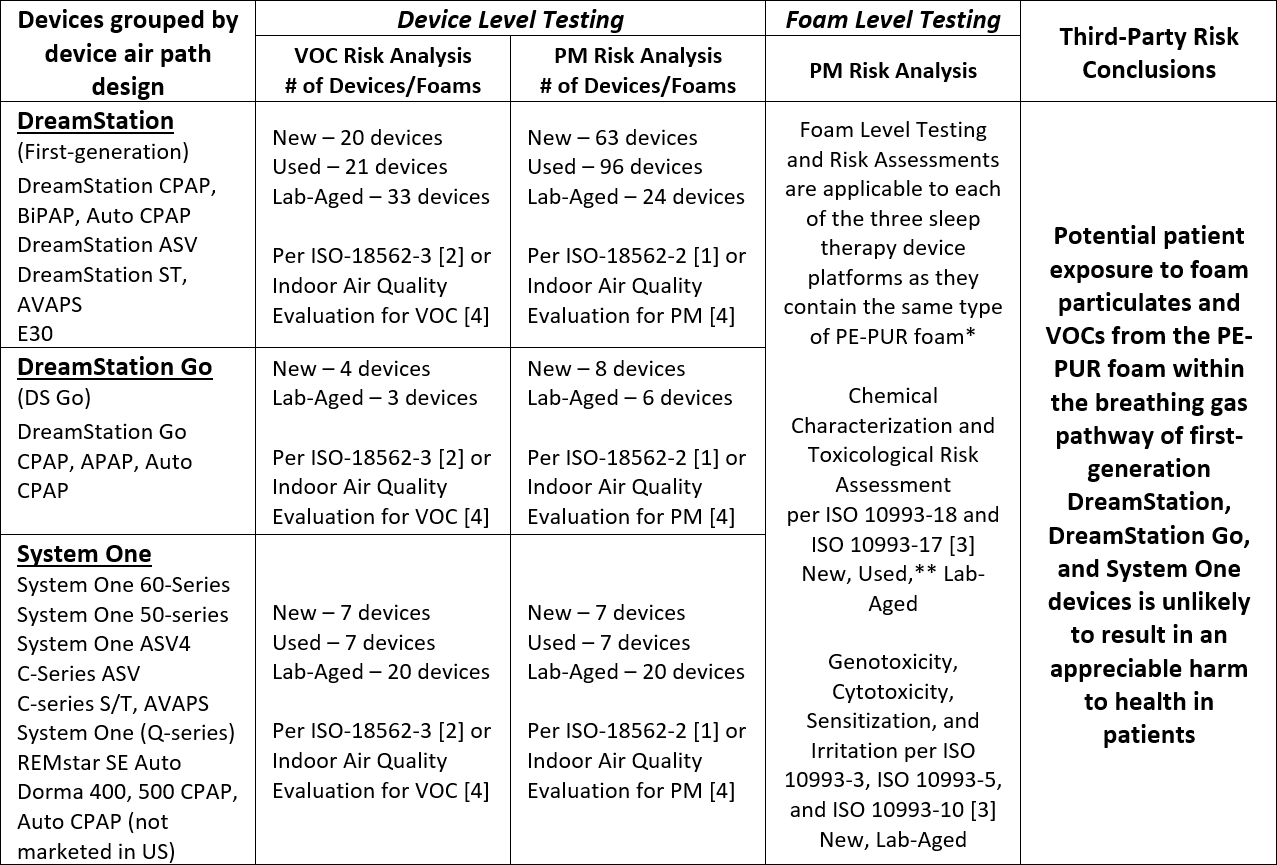
VOC: Volatile Organic Compound
PM: Particulate Matter
* The total amount of foam in the devices varies from approximately 1 g to 10 g, depending on the device airpath design and configuration. Devices within each platform share the same airpath design and configuration, including the amount of foam present.
** The foam from 7 different Used first-generation DreamStation devices was chemically characterized per ISO 10993-18 and -17 [3] and included foam representative of a range of visual degradation states.
Las pruebas ampliadas y las evaluaciones de riesgo toxicológico en múltiples dispositivos con espuma nuevos, usados y envejecidos en laboratorio no han mostrado daños apreciables para la salud por los COV detectados en base a las pruebas ISO 18562-3 [2], y una evaluación de riesgo por terceros concluyó que es improbable que la exposición a los COV de estos dispositivos resulte en un daño apreciable para la salud de los pacientes.
Se probaron dispositivos nuevos, envejecidos en laboratorio y usados, y todos cumplían los límites permitidos por la norma ISO 18562-2 [1] para las emisiones de partículas. Las pruebas se realizaron en dispositivos usados (es decir, dispositivos utilizados previamente por pacientes) con diversos grados de degradación (es decir, desde degradación no visible hasta degradación visible grave), dispositivos nuevos y dispositivos con espuma envejecida en laboratorio que se habían expuesto intencionadamente a temperaturas significativamente elevadas (≥80°C) y humedad (≥75% HR) para acelerar la degradación.
Además, las emisiones de partículas analizadas de los dispositivos usados con degradación visible no fueron estadísticamente diferentes de las emisiones de partículas de los dispositivos usados sin degradación, lo que sugiere que la degradación no contribuyó a niveles elevados apreciables de partículas respirables en los dispositivos analizados.
Incluso con el supuesto teórico y muy conservador de que toda la espuma pudiera degradarse y que un paciente estuviera expuesto a toda la espuma de PE-PUR degradada dentro de los dispositivos, la evaluación de riesgo realizada por terceros concluyó que es improbable que la exposición a partículas procedentes de la espuma degradada de estos dispositivos, incluidas las posibles partículas respirables y no respirables, provoque un daño apreciable para la salud de los pacientes.
Basándose en la inspección visual de la espuma en los dispositivos DreamStation de primera generación devueltos, se constató que la prevalencia de la degradación visible de la espuma era baja. La inspección visual sólo puede identificar la degradación visible de la espuma y no puede medir la generación de compuestos orgánicos volátiles ni cuantificar la pérdida de partículas, por lo que se realizaron pruebas y análisis adicionales como se describe anteriormente y en la actualización completa.
El impacto de la limpieza con ozono en la degradación de la espuma de los dispositivos DreamStation de primera generación
Philips Respironics ha completado las pruebas en dispositivos DreamStation de primera generación que han sido expuestos a la limpieza con ozono:
Las pruebas de COV de la norma ISO 18562-3 demostraron que tras 200 ciclos de limpieza con ozono -cada ciclo simulaba una noche de uso y luego una limpieza con ozono- el dietilenglicol (DEG) pasó a ser detectable como COV. En las pruebas se realizaron hasta 500 ciclos de limpieza con ozono, y un riesgo toxicológico de COV de esta degradación inducida por el ozono determinó que la exposición a las emisiones de COV de los dispositivos DreamStation de primera generación evaluados expuestos a la limpieza con ozono no sugiere ningún riesgo apreciable para la salud de los pacientes.
En cuanto a los riesgos asociados a las partículas respirables y no respirables, las pruebas realizadas hasta la fecha se han llevado a cabo en dispositivos con exposición conocida al ozono. Por ejemplo, dos dispositivos DreamStation de primera generación usados con exposición al ozono notificada por los usuarios se incluyeron en las pruebas de extraíbles y lixiviables, que constituyeron la base de una evaluación de riesgos toxicológicos de las partículas de espuma PE-PUR del dispositivo de terapia del sueño. Ese análisis colectivo de terceros concluyó que es improbable que la exposición a partículas procedentes de la espuma degradada de los dispositivos DreamStation de primera generación provoque un daño apreciable para la salud de los pacientes.
Como se publicó anteriormente, los datos de la DreamStation de primera generación indican que los dispositivos con limpieza con ozono notificada por el usuario tienen 14 veces más probabilidades de presentar una degradación visible significativa de la espuma/reducción del volumen en comparación con los dispositivos sin exposición al ozono notificada por el usuario. Esta observación es coherente con las pruebas de laboratorio, en las que los dispositivos DreamStation de primera generación expuestos a ciclos crecientes de limpieza con ozono presentaban una degradación visual cada vez más grave. Sin embargo, como se ha concluido anteriormente, es poco probable que esto provoque un daño apreciable para la salud de los pacientes.
Resumen de las pruebas en curso
Philips Respironics está finalizando varias pruebas y análisis. Se están completando las evaluaciones de riesgo de los dispositivos System One y DreamStation Go (que contienen la misma espuma que los dispositivos DreamStation de primera generación) tratados con limpieza por ozono. Para los dispositivos de ventilación Trilogy 100/200 y OmniLab Advanced Plus, continúan las pruebas de COV y PM, así como la evaluación química y la evaluación de riesgos toxicológicos. Estos dispositivos contienen un tipo diferente de espuma PE-PUR que los dispositivos DreamStation de primera generación [5]. Philips Respironics espera proporcionar una actualización al respecto en el tercer trimestre de 2023.
Orientación para profesionales sanitarios y pacientes
Se ruega a los pacientes que utilicen actualmente un dispositivo de terapia del sueño afectado que no se haya corregido y no se haya registrado todavía, que registren sus dispositivos para facilitar la corrección.
Philips Respironics sigue aconsejando a los pacientes que utilicen dispositivos de terapia del sueño afectados que aún no hayan sido reparados que se pongan en contacto con su médico o proveedor de atención sanitaria para decidir un tratamiento adecuado para su afección, que puede incluir dejar de utilizar su dispositivo, seguir utilizando su dispositivo afectado, utilizar otro dispositivo similar que no forme parte de la retirada o utilizar tratamientos alternativos para la apnea del sueño. Además, se aconseja a los pacientes que sigan las instrucciones y las pautas de limpieza y sustitución recomendadas por Philips Respironics para su dispositivo de terapia del sueño y sus accesorios. Los productos de limpieza con ozono y luz ultravioleta no son métodos de limpieza aprobados actualmente para los dispositivos o máscaras de terapia del sueño y no deben utilizarse.
Philips Respironics también sigue aconsejando a los usuarios de dispositivos de ventilación que se pongan en contacto con sus profesionales sanitarios antes de realizar cualquier cambio en su terapia.
Fundamento científico de los métodos de prueba
El diseño de los métodos de prueba aplicados se fundamentó científicamente en una consideración y mitigación exhaustivas de las limitaciones de las pruebas que son inherentes a cualquier norma de prueba y/o investigación científica. Para ilustrarlo, a continuación, se enumeran ejemplos de tales consideraciones y mitigaciones.
La base científica de los métodos de ensayo aplicados incluía una consideración exhaustiva y la mitigación de las limitaciones de los ensayos, por ejemplo:
Notes
* Voluntary recall notification in the US/field safety notice for the rest of the world.
[1] ISO 18562-2: Biocompatibility evaluation of breathing gas pathways in healthcare applications – Part 2: Tests for emissions of particulate matter.
[2] ISO 18562-3: Biocompatibility evaluation of breathing gas pathways in healthcare applications – Part 3: Tests for emissions of volatile organic compounds.
[3] ISO 10993: Biological evaluation of medical devices; Part 1: Evaluation and testing within a risk management process; Part 3: Tests for genotoxicity, carcinogenicity and reproductive toxicity; Part 5: Tests for in vitro cytotoxicity; Part 10: Tests for irritation and skin sensitization; Part 17: Establishment of allowable limits for leachable substances; Part 18: Chemical characterization of medical device materials within a risk management process.
[4] The standard that was used for tests prior to ISO 18562.
[5] First-generation DreamStation, System One and DreamStation Go devices contain Type A PE-PUR foam, while Trilogy 100/200 devices contain Type B PE-PUR foam, and OmniLab Advanced Plus devices contain Type A and Type B PE-PUR foams. The known differences between the Type A and Type B foams are that Type B foam can be used with an acrylic pressure sensitive adhesive, has a lower density, has a different thickness, and also contains an additive to reduce potential flammability.
Sobre Royal Philips
Royal Philips (NYSE: PHG, AEX: PHI) es una empresa líder en tecnologías de la salud, centrada en mejorar la salud y el bienestar de las personas, y facilitar la obtención de mejores resultados en el ciclo de la salud, desde los hábitos saludables y la prevención, hasta el diagnóstico, tratamiento y atención domiciliaria. Philips hace uso de su avanzada tecnología y de sus profundos conocimientos clínicos y del consumidor para ofrecer soluciones integradas. Con sede en los Países Bajos, la compañía es líder en diagnóstico por imagen, terapia guiada por imagen, monitorización de pacientes e informática de la salud, así como en salud del consumidor y atención domiciliaria. Philips ha registrado unas ventas de 17.800 millones de euros en 2022 y emplea aproximadamente a 74.000 empleados, con operaciones comerciales y servicios en más de 100 países. Todas las noticias sobre Philips se encuentran en nuestro Centro de noticias
Forward-looking statements
This statement contains certain forward-looking statements with respect to the financial condition, results of operations and business of Philips and certain of the plans and objectives of Philips with respect to these items. Examples of forward-looking statements include statements made about the strategy, estimates of sales growth, future EBITA, future developments in Philips’ organic business and the completion of acquisitions and divestments. By their nature, these statements involve risk and uncertainty because they relate to future events and circumstances and there are many factors that could cause actual results and developments to differ materially from those expressed or implied by these statements.
Temas
Contactos

Steve Klink
Philips Global Press Office Tel: +31 6 10888824
You are about to visit a Philips global content page
Continue
César García Requena
Brand & Communications Manager Health System Philips Ibérica Tel : +34 91 566 95 25
You are about to visit a Philips global content page
ContinueMaterial gráfico